- Συγγραφέας Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:05.
- Τελευταία τροποποίηση 2025-01-23 12:15.
Η αραίωση είναι η διαδικασία που κάνει ένα συμπυκνωμένο διάλυμα πιο αραιό. Υπάρχουν διάφοροι λόγοι για τους οποίους κάποιος μπορεί να θέλει να κάνει αραίωση, από σοβαρούς έως απλούς λόγους. Για παράδειγμα, οι βιοχημικοί αραιώνουν διαλύματα από τις συμπυκνωμένες μορφές τους για να κάνουν νέα διαλύματα για χρήση σε πειράματα, ενώ, από την άλλη πλευρά, οι μπάρμαν συχνά αραιώνουν το ποτό με αναψυκτικά ή χυμούς για να κάνουν τα κοκτέιλ πιο νόστιμα. Ο γενικός τύπος για τον υπολογισμό της αραίωσης είναι ντο1V1 = Γ2V2, με Γ1 και Γ2 αντιπροσωπεύει τις αρχικές και τελικές συγκεντρώσεις του διαλύματος, αντίστοιχα, και V1 και V2 αντιπροσωπεύει τον όγκο.
Βήμα
Μέθοδος 1 από 2: Ακριβής αραίωση συμπυκνωμάτων μέσω της εξίσωσης αραίωσης

Βήμα 1. Καθορίστε τι γνωρίζετε και τι δεν γνωρίζετε
Αραίωση στη χημεία σημαίνει συνήθως λήψη μικρής ποσότητας διαλύματος του οποίου γνωρίζετε τη συγκέντρωση, στη συνέχεια προσθήκη ουδέτερου υγρού (όπως νερό) για να φτιάξετε ένα νέο διάλυμα με μεγαλύτερο όγκο αλλά χαμηλότερη συγκέντρωση. Αυτό γίνεται πολύ συχνά σε εργαστήρια χημείας, επειδή, για λόγους αποτελεσματικότητας, τα αντιδραστήρια αποθηκεύονται συχνά σε πολύ υψηλές συγκεντρώσεις, τα οποία στη συνέχεια αραιώνονται για χρήση σε πειράματα. Συνήθως, στις περισσότερες πραγματικές καταστάσεις, θα γνωρίζετε τη συγκέντρωση του αρχικού σας διαλύματος και τη συγκέντρωση ή τον όγκο που θέλετε να είναι η τελική σας συγκέντρωση, αλλά όχι τον όγκο της αρχικής λύσης που χρειάζεστε για να λάβετε την τελική λύση.
- Ωστόσο, σε άλλες καταστάσεις (ειδικά σε σχολικά προβλήματα), μπορεί να χρειαστεί να βρείτε άλλα κομμάτια του παζλ - για παράδειγμα, μπορεί να σας δοθεί ένας αρχικός όγκος και συγκέντρωση και στη συνέχεια να σας ζητηθεί να βρείτε την τελική συγκέντρωση εάν αραιώσετε ένα διάλυμα. στον επιθυμητό όγκο. Σε κάθε περίπτωση αραίωσης, είναι χρήσιμο να σημειώσετε τις γνωστές και άγνωστες μεταβλητές πριν ξεκινήσετε.
-
Ας τελειώσουμε με τα παραδείγματα ερωτήσεων. Ας υποθέσουμε ότι μας ζητείται να αραιώσουμε ένα διάλυμα 5 Μ με νερό για να φτιάξουμε 1 λίτρο ενός διαλύματος 1 mM Το Σε αυτή την περίπτωση, γνωρίζουμε τη συγκέντρωση του αρχικού μας διαλύματος και τον όγκο και την τελική συγκέντρωση που θέλουμε, αλλά όχι την ποσότητα του αρχικού διαλύματος που πρέπει να προσθέσουμε με νερό για να επιτύχουμε το επιθυμητό αποτέλεσμα.
Υπενθύμιση: Στη χημεία, το Μ είναι μια μέτρηση της συγκέντρωσης που ονομάζεται Molarity, η οποία δηλώνει τα γραμμομόρια μιας ουσίας ανά λίτρο
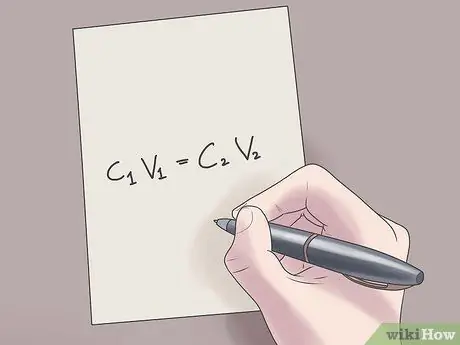
Βήμα 2. Συνδέστε τις τιμές σας στον τύπο C1V1 = Γ2V2.
Σε αυτόν τον τύπο, Γ1 είναι η αρχική συγκέντρωση του διαλύματος, V1 είναι ο όγκος του αρχικού διαλύματος, C2 είναι η τελική συγκέντρωση του διαλύματος, και V2 είναι ο όγκος του τελικού διαλύματος. Η προσθήκη γνωστών τιμών σε αυτήν την εξίσωση θα σας βοηθήσει να βρείτε άγνωστες τιμές με λιγότερη δυσκολία.
- Μπορεί να σας φανεί χρήσιμο να βάλετε ένα ερωτηματικό μπροστά από τη μονάδα που θέλετε να αναζητήσετε για να σας βοηθήσει να το λύσετε.
-
Ας συνεχίσουμε το παράδειγμά μας. Θα εισαγάγουμε τις τιμές που γνωρίζουμε ως εξής:
- ντο1V1 = Γ2V2
- (5 Μ) V1 = (1 mM) (1 L). Οι δύο συγκεντρώσεις μας έχουν διαφορετικές μονάδες. Ας σταματήσουμε εδώ και προχωράμε στο επόμενο βήμα.

Βήμα 3. Εξετάστε τυχόν διαφορές μονάδας
Δεδομένου ότι οι λύσεις περιλαμβάνουν αλλαγές στη συγκέντρωση (που μερικές φορές μπορεί να είναι αρκετά μεγάλες), δεν είναι ασυνήθιστο οι δύο μεταβλητές στην εξίσωση σας να έχουν διαφορετικές μονάδες. Παρόλο που αυτό είναι εύκολο να το παραβλέψουμε, οι άνισες μονάδες στην εξίσωση μπορεί να προκαλέσουν εσφαλμένη απάντηση. Πριν τελειώσετε, μετατρέψτε όλες τις τιμές με διαφορετικές συγκεντρώσεις και/ή μονάδες όγκου.
-
Στο παράδειγμά μας, χρησιμοποιούμε διαφορετικές μονάδες για συγκεντρώσεις Μ (γομφίοι) και mM (χιλιοστόγραμμα). Ας αλλάξουμε τη δεύτερη μέτρηση σε Μ:
- 1 mM × 1 M/1.000 mM
- = 0,001 Μ

Βήμα 4. Τελειώστε
Μόλις όλες οι μονάδες είναι ίσες, λύστε την εξίσωση σας. Αυτό μπορεί σχεδόν πάντα να γίνει με απλή άλγεβρα.
-
Σταματάμε το πρόβλημά μας εδώ: (5 Μ) V1 = (1 mM) (1 L). Ας βρούμε την τιμή του V1 με τη νέα μας μονάδα.
- (5 Μ) V1 = (0,001 Μ) (1 Λ)
- V1 = (0,001 Μ) (1 Λ)/(5 Μ).
-
V1 = 0.0002 L, ή 0.2 mL.

Βήμα 5. Κατανοήστε πώς να χρησιμοποιήσετε σωστά την απάντησή σας
Ας υποθέσουμε ότι βρήκατε την τιμή που λείπει, αλλά δεν είστε σίγουροι πώς να χρησιμοποιήσετε αυτές τις νέες πληροφορίες στην πραγματική αραίωση που πρέπει να κάνετε. Αυτό είναι κατανοητό - η γλώσσα των μαθηματικών και της επιστήμης μερικές φορές δεν ταιριάζει με τον πραγματικό κόσμο. Όταν γνωρίζετε τις τέσσερις τιμές στην εξίσωση Γ1V1 = Γ2V2, κάντε την αραίωση ως εξής:
- Μετρήστε την ένταση V1 από ένα διάλυμα με συγκέντρωση C1Το Στη συνέχεια, προσθέστε αρκετό αραιωτικό (νερό, κ.λπ.) για να γίνει ο συνολικός όγκος V2Το Αυτή η νέα λύση θα έχει τη συγκέντρωση που θέλετε (Γ2).
- Στο παράδειγμά μας, για παράδειγμα, μετράμε πρώτα 0,2 mL διαλύματος 5 Μ. Στη συνέχεια, θα προσθέσουμε αρκετό νερό για να αυξήσουμε τον όγκο του διαλύματος σε 1 L: 1 L - 0,0002 L = 0,9998 L, ή 999, 8 mL Το Με άλλα λόγια, θα προσθέσουμε 999,8 mL νερού στο μικρό μας διάλυμα δείγματος. Το νέο, αραιωμένο διάλυμα μας έχει συγκέντρωση 1 mM, η οποία είναι η επιθυμητή συγκέντρωση.
Μέθοδος 2 από 2: Παρασκευή μιας απλής και πρακτικής λύσης αραίωσης

Βήμα 1. Διαβάστε οποιαδήποτε συσκευασία για πληροφορίες
Υπάρχουν διάφοροι λόγοι για τους οποίους μπορεί να θέλετε να φτιάξετε ένα διάλυμα αραίωσης στο σπίτι, στην κουζίνα ή σε άλλο μη χημικό εργαστήριο. Για παράδειγμα, η παρασκευή χυμού πορτοκαλιού από ένα απλό συμπύκνωμα είναι μια αραίωση. Σε πολλές περιπτώσεις, το προϊόν που πρέπει να αραιωθεί περιέχει πληροφορίες σχετικά με την αραίωση που πρέπει να γίνει, κάπου στη συσκευασία. Μπορεί να έχουν ακριβείς οδηγίες που πρέπει να ακολουθήσουν. Ακολουθούν ορισμένα πράγματα που πρέπει να αναζητήσετε όταν αναζητάτε πληροφορίες:
- Ο όγκος του προϊόντος που χρησιμοποιείται
- Όγκος διαλυτικού που χρησιμοποιήθηκε
- Τύπος αραιωτικού που χρησιμοποιείται (συνήθως νερό)
- Ειδικές οδηγίες ανάμιξης
- Ενδέχεται να μην δείτε πληροφορίες σχετικά με την ακριβή συγκέντρωση του χρησιμοποιούμενου υγρού. Αυτές οι πληροφορίες δεν είναι χρήσιμες για τον μέσο καταναλωτή.

Βήμα 2. Προσθέστε την ουσία που δρα ως διαλύτης στο συμπυκνωμένο διάλυμα
Για απλές οικιακές αραιώσεις, όπως αυτές που μπορεί να κάνετε στην κουζίνα, χρειάζεται μόνο να γνωρίζετε τον όγκο του συμπυκνώματος που χρησιμοποιείτε και την κατά προσέγγιση τελική συγκέντρωση που θέλετε πριν ξεκινήσετε. Αραιώστε το συμπύκνωμα με κατάλληλη ποσότητα διαλύτη, η οποία καθορίζεται ανάλογα με τον όγκο του αρχικού χρησιμοποιούμενου συμπυκνώματος. Δες παρακάτω:
- Για παράδειγμα, αν θέλαμε να αραιώσουμε 1 φλιτζάνι συμπυκνωμένο χυμό πορτοκαλιού στο 1/4 της αρχικής του συγκέντρωσης, θα προσθέταμε 3 φλιτζάνια νερό στο συμπύκνωμα. Το τελικό μας μείγμα θα έχει 1 φλιτζάνι συμπυκνωμένο σε 4 φλιτζάνια ολόκληρο υγρό - το 1/4 της αρχικής του συγκέντρωσης.
- Ακολουθεί ένα πιο περίπλοκο παράδειγμα: Αν θέλαμε να αραιώσουμε 2/3 φλιτζάνι συμπυκνωμένου διαλύματος στο 1/4 της αρχικής του συγκέντρωσης, θα προσθέσουμε 2 φλιτζάνια νερό, διότι 2/3 φλιτζάνι ισούται με 1/4 φορές 2 & 2/3 φλιτζάνι ολόκληρο υγρό.
- Φροντίστε να προσθέσετε την ουσία σας σε ένα δοχείο αρκετά μεγάλο για να κρατήσει τον τελικό όγκο που θέλετε - ένα μεγάλο μπολ ή ένα παρόμοιο δοχείο.

Βήμα 3. Αγνοήστε τον όγκο της σκόνης στις περισσότερες περιπτώσεις
Η προσθήκη σκόνης (όπως ορισμένα μείγματα ποτών) σε ένα υγρό συνήθως δεν θεωρείται αραίωση. Η μεταβολή του όγκου που προκύπτει από την προσθήκη μικρής ποσότητας σκόνης στο υγρό είναι συνήθως αρκετά μικρή ώστε να είναι αμελητέα. Με άλλα λόγια, όταν προσθέτετε μια μικρή ποσότητα σκόνης σε ένα υγρό, απλά προσθέστε τη σκόνη στον επιθυμητό τελικό όγκο του υγρού και ανακατέψτε.
Προειδοποίηση
- Ακολουθήστε τις οδηγίες ασφαλείας που παρέχονται από τον κατασκευαστή ή απαιτούνται από την εταιρεία σας. Αυτό είναι ιδιαίτερα σημαντικό εάν πρέπει να αραιώσετε το οξύ διάλυμα.
- Η εργασία με όξινα διαλύματα μπορεί να απαιτεί πιο λεπτομερή μέτρα ασφαλείας και οδηγίες από ό, τι με μη όξινα διαλύματα.






