- Συγγραφέας Jason Gerald [email protected].
- Public 2024-02-01 14:12.
- Τελευταία τροποποίηση 2025-06-01 06:05.
Έχετε αφήσει ποτέ ένα μπουκάλι νερό στον καυτό ήλιο για λίγες ώρες και έχετε ακούσει έναν ελαφρύ ήχο "συριγμού" όταν το ανοίξατε; Αυτό οφείλεται σε μια αρχή που ονομάζεται πίεση ατμού. Στη χημεία, η πίεση ατμών είναι η πίεση που ασκείται από τα τοιχώματα ενός κλειστού δοχείου όταν η χημική ουσία σε αυτό εξατμίζεται (μετατρέπεται σε αέριο). Για να βρείτε την πίεση ατμών σε μια δεδομένη θερμοκρασία, χρησιμοποιήστε την εξίσωση Clausius-Clapeyron: ln (P1/P2) = (ΔHατμός/R) ((1/T2) - (1/T1)).
Βήμα
Μέθοδος 1 από 3: Χρήση της εξίσωσης Clausius-Clapeyron
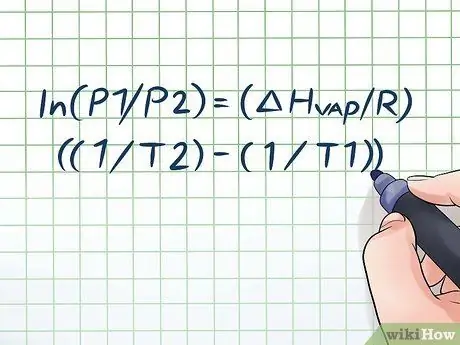
Βήμα 1. Γράψτε την εξίσωση Clausius-Clapeyron
Ο τύπος που χρησιμοποιείται για τον υπολογισμό της πίεσης ατμών με την αλλαγή της πίεσης ατμών με την πάροδο του χρόνου ονομάζεται εξίσωση Clausius - Clapeyron (πήρε το όνομά του από τους φυσικούς Rudolf Clausius και Benoît Paul mile Clapeyron.) Αυτός είναι βασικά ο τύπος που θα χρειαστείτε για να λύσετε τα περισσότερα είδη προβλημάτων Ερωτήσεις για την πίεση ατμών βρίσκονται συχνά στα μαθήματα φυσικής και χημείας. Ο τύπος είναι ο εξής: ln (P1/P2) = (ΔHατμός/R) ((1/T2) - (1/T1)) Το Σε αυτόν τον τύπο, οι μεταβλητές αντιπροσωπεύουν:
-
Ηατμός:
Η ενθαλπία της εξάτμισης ενός υγρού. Αυτή η ενθαλπία μπορεί συνήθως να βρεθεί στον πίνακα στο πίσω μέρος του σχολικού βιβλίου χημείας.
-
R:
Η πραγματική/καθολική σταθερά αερίου, ή 8,314 J/(K × Mol).
-
Q1:
Η θερμοκρασία στην οποία είναι γνωστή η πίεση ατμών (ή η αρχική θερμοκρασία).
-
Τ2:
Η θερμοκρασία στην οποία η πίεση ατμών είναι άγνωστη/ήθελε να βρεθεί (ή η τελική θερμοκρασία).
-
P1 και P2:
Πίεση ατμών σε θερμοκρασίες Τ1 και Τ2, αντίστοιχα.

Βήμα 2. Εισαγάγετε τις μεταβλητές που γνωρίζετε
Η εξίσωση Clausius-Clapeyron φαίνεται περίπλοκη επειδή έχει πολλές διαφορετικές μεταβλητές, αλλά στην πραγματικότητα δεν είναι τόσο δύσκολο αν έχετε τις σωστές πληροφορίες. Τα περισσότερα βασικά προβλήματα πίεσης ατμού θα απαριθμούν δύο τιμές θερμοκρασίας και μία τιμή πίεσης ή δύο τιμές πίεσης και μία τιμή θερμοκρασίας - μόλις το καταλάβετε, η επίλυση αυτής της εξίσωσης είναι πολύ εύκολη.
- Για παράδειγμα, πείτε ότι μας λένε ότι έχουμε ένα δοχείο γεμάτο υγρό στους 295 K του οποίου η πίεση ατμών είναι 1 ατμόσφαιρα (atm). Η ερώτησή μας είναι: Ποια είναι η πίεση ατμών στους 393 Κ; Έχουμε δύο τιμές θερμοκρασίας και μία τιμή πίεσης, οπότε μπορούμε να βρούμε τις άλλες τιμές πίεσης χρησιμοποιώντας την εξίσωση Clausius-Clapeyron. Συνδέοντας τις μεταβλητές μας, παίρνουμε ln (1/P2) = (ΔHατμός/Ρ) ((1/393) - (1/295)).
- Σημειώστε ότι, για την εξίσωση Clausius-Clapeyron, πρέπει πάντα να χρησιμοποιείτε την τιμή θερμοκρασίας Κέλβιν Το Μπορείτε να χρησιμοποιήσετε οποιαδήποτε τιμή πίεσης αρκεί οι τιμές για P1 και P2 να είναι οι ίδιες.

Βήμα 3. Εισαγάγετε τις σταθερές σας
Η εξίσωση Clausius-Clapeyron έχει δύο σταθερές: R και HατμόςΤο Το R ισούται πάντα με 8,314 J/(K × Mol). Ωστόσο, ο Χατμός (ενθαλπία εξάτμισης) εξαρτάται από την ουσία της οποίας την πίεση ατμών αναζητάτε. Όπως σημειώθηκε παραπάνω, μπορείτε συνήθως να βρείτε τις τιμές του Ηατμός για διάφορες ουσίες στο πίσω μέρος ενός εγχειριδίου χημείας ή φυσικής ή σε απευθείας σύνδεση (όπως, για παράδειγμα, εδώ.)
-
Στο παράδειγμά μας, ας υποθέσουμε ότι το υγρό μας είναι καθαρό νερό.
Αν κοιτάξουμε στον πίνακα τις τιμές του Ηατμός, βρίσκουμε ότι η Ηατμός το καθαρό νερό είναι περίπου 40,65 KJ/mol. Δεδομένου ότι η τιμή H είναι σε joules και όχι σε kilojoules, μπορούμε να τη μετατρέψουμε σε 40.650 J/mol.
- Συνδέοντας τις σταθερές μας, παίρνουμε ln (1/P2) = (40.650/8, 314) ((1/393) - (1/295)).
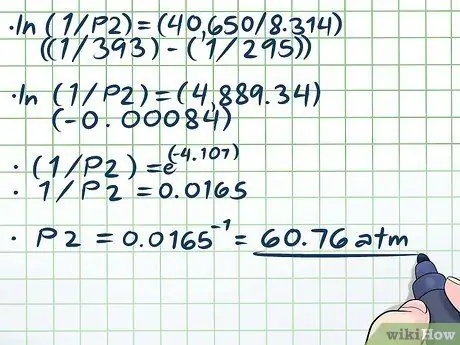
Βήμα 4. Λύστε την εξίσωση
Αφού συμπεριλάβετε όλες τις μεταβλητές στην εξίσωση εκτός από αυτήν που ψάχνετε, προχωρήστε στην επίλυση της εξίσωσης σύμφωνα με τους κανόνες της συνηθισμένης άλγεβρας.
-
Το μόνο δύσκολο μέρος της επίλυσης της εξίσωσης μας (ln (1/P2) = (40.650/8, 314) ((1/393) - (1/295))) επιλύει το φυσικό αρχείο καταγραφής (ln). Για να αφαιρέσετε το φυσικό ημερολόγιο, χρησιμοποιήστε και τις δύο πλευρές της εξίσωσης ως εκθέτες για τη μαθηματική σταθερά e. Με άλλα λόγια, ln (x) = 2 → eln (x) = ε2 → x = e2.
- Τώρα, ας λύσουμε την εξίσωση μας:
- ln (1/P2) = (40.650/8, 314) ((1/393) - (1/295))
- ln (1/P2) = (4889, 34) (-0, 00084)
- (1/Ρ2) = ε(-4, 107)
- 1/Ρ2 = 0,0165
-
Ρ2 = 0,0165-1 = 60, 76 atm.
Αυτό έχει νόημα - σε κλειστό δοχείο, η αύξηση της θερμοκρασίας σε σχεδόν 100 μοίρες (σε σχεδόν 20 μοίρες πάνω από το σημείο βρασμού) θα παράγει πολύ ατμό, αυξάνοντας γρήγορα την πίεση.
Μέθοδος 2 από 3: Εύρεση πίεσης ατμού με διαλυμένο διάλυμα
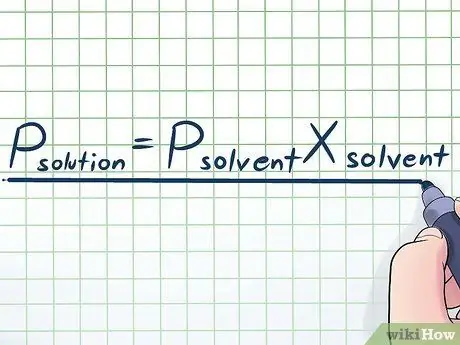
Βήμα 1. Γράψτε τον νόμο του Raoult
Στην πραγματική ζωή, σπάνια δουλεύουμε με ένα καθαρό υγρό - συνήθως, δουλεύουμε με ένα υγρό που είναι ένα μείγμα αρκετών διαφορετικών ουσιών. Μερικά από τα πιο συχνά χρησιμοποιούμενα μείγματα γίνονται με τη διάλυση μιας μικρής ποσότητας μιας συγκεκριμένης χημικής ουσίας που ονομάζεται διαλυμένη ουσία σε πολλές χημικές ουσίες που ονομάζονται διαλύτες για την παρασκευή ενός διαλύματος. Σε αυτές τις περιπτώσεις, είναι χρήσιμο να γνωρίζουμε μια εξίσωση που ονομάζεται Νόμος του Raoult (που πήρε το όνομά της από τον φυσικό François-Marie Raoult), η οποία είναι γραμμένη ως εξής: Πδιαλυτό= Ρδιαλυτικό μέσοΧδιαλυτικό μέσο Το Σε αυτόν τον τύπο, οι μεταβλητές αντιπροσωπεύουν?
-
Πδιαλυτό:
Πίεση ατμών ολόκληρου του διαλύματος (όλα τα στοιχεία συνδυασμένα)
-
Πδιαλυτικό μέσο:
Πίεση ατμών διαλύτη
-
Χδιαλυτικό μέσο:
Μόριο κλάσμα διαλύτη
- Μην ανησυχείτε εάν δεν γνωρίζετε όρους όπως το κλάσμα τυφλοπόντικας - θα τους εξηγήσουμε στα επόμενα βήματα.

Βήμα 2. Προσδιορίστε τον διαλύτη και τη διαλυμένη ουσία στο διάλυμα σας
Πριν μπορέσετε να υπολογίσετε την πίεση ατμών ενός μικτού υγρού, πρέπει να προσδιορίσετε τις ουσίες που χρησιμοποιείτε. Για υπενθύμιση, ένα διάλυμα σχηματίζεται όταν μια διαλυμένη ουσία διαλύεται σε ένα διαλύτη - η χημική ουσία που διαλύεται ονομάζεται πάντα διαλυμένη ουσία και η χημική ουσία που την κάνει να διαλύεται ονομάζεται πάντα διαλύτης.
- Ας εργαστούμε χρησιμοποιώντας τα απλά παραδείγματα σε αυτήν την ενότητα για να επεξηγήσουμε τις έννοιες που συζητάμε. Για το παράδειγμά μας, ας πούμε ότι θέλουμε να βρούμε την πίεση ατμών του σιροπιού ζάχαρης. Παραδοσιακά, το σιρόπι ζάχαρης είναι υδατοδιαλυτή ζάχαρη (αναλογία 1: 1), οπότε μπορούμε να το πούμε αυτό η ζάχαρη είναι η διαλυμένη ουσία και το νερό ο διαλύτης μας.
- Σημειώστε ότι ο χημικός τύπος για τη σακχαρόζη (επιτραπέζια ζάχαρη) είναι C12Η22Ο11Το Αυτός ο χημικός τύπος θα είναι πολύ σημαντικός.
Βήμα 3. Βρείτε τη θερμοκρασία του διαλύματος
Όπως είδαμε στο τμήμα Clausius Clapeyron παραπάνω, η θερμοκρασία ενός υγρού θα επηρεάσει την πίεση ατμών του. Γενικά, όσο υψηλότερη είναι η θερμοκρασία, τόσο μεγαλύτερη είναι η πίεση ατμών - καθώς αυξάνεται η θερμοκρασία, περισσότερο από το υγρό θα εξατμιστεί και θα σχηματιστεί ατμός, αυξάνοντας την πίεση στο δοχείο.
Στο παράδειγμά μας, ας πούμε ότι η θερμοκρασία του σιροπιού ζάχαρης σε αυτό το σημείο είναι 298 Κ (περίπου 25 C).
Βήμα 4. Βρείτε την πίεση ατμών του διαλύτη
Τα χημικά υλικά αναφοράς έχουν συνήθως τιμές πίεσης ατμού για πολλές κοινώς χρησιμοποιούμενες ουσίες και ενώσεις, αλλά αυτές οι τιμές πίεσης είναι συνήθως έγκυρες μόνο εάν η ουσία έχει θερμοκρασία 25 C/298 K ή το σημείο βρασμού της. Εάν το διάλυμα σας έχει μία από αυτές τις θερμοκρασίες, μπορείτε να χρησιμοποιήσετε μια τιμή αναφοράς, αλλά αν όχι, θα χρειαστεί να βρείτε την πίεση ατμών σε αυτήν τη θερμοκρασία.
- Το Clausius -Clapeyron μπορεί να βοηθήσει - χρησιμοποιήστε μια τάση ατμών αναφοράς και 298 K (25 C) για Ρ1 και Τ1 αντίστοιχα.
- Στο παράδειγμά μας, το μείγμα μας έχει θερμοκρασία 25 C, οπότε μπορούμε εύκολα να χρησιμοποιήσουμε τον εύκολο πίνακα αναφοράς. Γνωρίζουμε ότι στους 25 C, το νερό έχει πίεση ατμών 23,8 mm HG

Βήμα 5. Βρείτε το γραμμομοριακό κλάσμα του διαλύτη σας
Το τελευταίο πράγμα που πρέπει να κάνουμε για να το λύσουμε είναι να βρούμε το γραμμομοριακό κλάσμα του διαλύτη μας. Η εύρεση του μοριακού κλάσματος είναι εύκολη: απλώς μετατρέψτε τις ενώσεις σας σε κρεατοελιές και, στη συνέχεια, βρείτε το ποσοστό κάθε ένωσης στο συνολικό αριθμό των γραμμομορίων στην ουσία. Με άλλα λόγια, το γραμμομοριακό κλάσμα κάθε ένωσης είναι ίσο με (moles της ένωσης)/(συνολικός αριθμός moles στην ουσία).
-
Ας υποθέσουμε ότι η συνταγή μας για χρήσεις σιροπιού ζάχαρης 1 λίτρο (L) νερό και 1 λίτρο σακχαρόζη (ζάχαρη).
Σε αυτή την περίπτωση, πρέπει να βρούμε τον αριθμό των γραμμομορίων κάθε ένωσης. Για να γίνει αυτό, θα βρούμε τη μάζα κάθε ένωσης και στη συνέχεια θα χρησιμοποιήσουμε τη γραμμομοριακή μάζα της ουσίας για να τη μετατρέψουμε σε σπίλους.
- Μάζα (1 λίτρο νερό): 1.000 γραμμάρια (g)
- Μάζα (1 L ακατέργαστης ζάχαρης): Περίπου 1.056, 8 g
- Moles (νερό): 1.000 γραμμάρια × 1 mol/18.015 g = 55.51 mol
- Moles (σακχαρόζη): 1.056, 7 γραμμάρια × 1 mol/342.2965 g = 3.08 moles (σημειώστε ότι μπορείτε να βρείτε τη γραμμομοριακή μάζα της σακχαρόζης από τον χημικό της τύπο, C12Η22Ο11.)
- Σύνολο moles: 55,51 + 3,08 = 58,59 mol
- Μοριακό κλάσμα νερού: 55, 51/58, 59 = 0, 947
Βήμα 6. Τελειώστε
Τέλος, έχουμε όλα όσα χρειαζόμαστε για να λύσουμε την εξίσωση του Νόμου του Raoult. Αυτό το μέρος είναι πολύ εύκολο: απλώς συνδέστε τις τιμές σας για τις μεταβλητές στην απλοποιημένη εξίσωση του Νόμου του Raoult στην αρχή αυτής της ενότητας (Πδιαλυτό = Ρδιαλυτικό μέσοΧδιαλυτικό μέσο).
- Εισάγοντας τις αξίες μας, λαμβάνουμε:
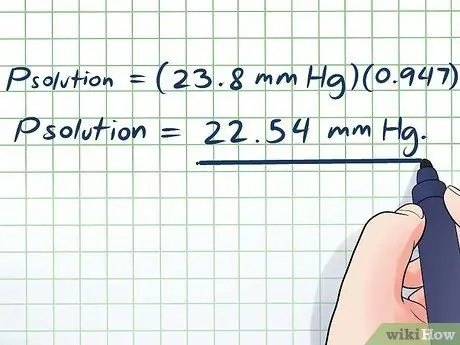
- Πλύση = (23,8 mm Hg) (0, 947)
-
Πλύση = 22,54 mm Hg.
Το αποτέλεσμα είναι λογικό - σε επίπεδο mole, υπάρχει πολύ λίγη ζάχαρη διαλυμένη σε πολύ νερό (αν και σε πραγματικούς όρους, και τα δύο συστατικά έχουν τον ίδιο όγκο), οπότε η πίεση ατμών θα μειωθεί μόνο ελαφρώς.
Μέθοδος 3 από 3: Εύρεση πίεσης ατμού σε ειδικές περιπτώσεις

Βήμα 1. Να είστε προσεκτικοί με τις τυπικές συνθήκες θερμοκρασίας και πίεσης
Οι επιστήμονες χρησιμοποιούν συχνά ένα σύνολο τιμών θερμοκρασίας και πίεσης ως ένα «πρότυπο» εύχρηστο. Αυτές οι τιμές ονομάζονται Standard Temperature and Pressure (ή STP). Τα προβλήματα πίεσης ατμού συχνά αναφέρονται σε συνθήκες STP, επομένως είναι σημαντικό να θυμόμαστε αυτές τις τιμές. Οι τιμές STP ορίζονται ως:
- Θερμοκρασία: 273, 15 Κ / 0 C / 32 F
- Πίεση: 760 mm Hg / 1 atm / 101, 325 kilopascals

Βήμα 2. Αναδιατάξτε την εξίσωση Clausius-Clapeyron για να βρείτε τις άλλες μεταβλητές
Στο παράδειγμά μας στο Μέρος 1, είδαμε ότι η εξίσωση Clausius - Clapeyron είναι πολύ χρήσιμη για την εύρεση της τάσης ατμών για καθαρές ουσίες. Ωστόσο, δεν θα σας ζητήσουν όλες οι ερωτήσεις να αναζητήσετε P1 ή P2 - πολλές θα σας ζητήσουν να βρείτε την τιμή της θερμοκρασίας ή μερικές φορές ακόμη και την τιμή H.ατμόςΤο Ευτυχώς, σε αυτές τις περιπτώσεις, η σωστή απάντηση είναι απλώς θέμα αναδιάταξης της εξίσωσης έτσι ώστε οι μεταβλητές που θέλετε να λύσετε να είναι ξεχωριστές στη μία πλευρά του σημείου ίσων.
- Για παράδειγμα, ας πούμε ότι έχουμε ένα άγνωστο υγρό με πίεση ατμών 25 torr στους 273 K και 150 torr στους 325 K και θέλουμε να βρούμε την ενθαλπία εξάτμισης αυτού του υγρού (ΔHατμός). Μπορούμε να το λύσουμε έτσι:
- ln (P1/P2) = (ΔHατμός/R) ((1/T2) - (1/T1))
- (ln (P1/P2))/((1/T2) - (1/T1)) = (ΔHατμός/R)
- R × (ln (P1/P2))/((1/T2) - (1/T1)) = Hατμός Τώρα, εισάγουμε τις τιμές μας:
- 8, 314 J/(K × Mol) (-1, 79)/(-0, 00059) = Hατμός
- 8, 314 J/(K × Mol) × 3,033, 90 = Ηατμός = 25,223, 83 J/mol

Βήμα 3. Υπολογίστε την πίεση ατμών της διαλυμένης ουσίας όταν η ουσία παράγει ατμούς
Στο παραπάνω παράδειγμα του Νόμου Raoult, η διαλυμένη ουσία, η ζάχαρη, δεν ασκεί καμία πίεση από μόνη της σε κανονικές θερμοκρασίες (σκεφτείτε - πότε ήταν η τελευταία φορά που είδατε να εξατμίζεται ένα μπολ ζάχαρης στο πάνω ντουλάπι σας;) Ωστόσο, όταν η διαλυμένη ουσία σας εξατμιστεί, αυτό θα επηρεάσει την πίεση ατμών σας. Το υπολογίζουμε αυτό χρησιμοποιώντας μια τροποποιημένη έκδοση της εξίσωσης του νόμου Raoult: Πλύση = (Σελχημική ένωσηΧχημική ένωση) Το σύμβολο σίγμα (Σ) σημαίνει ότι χρειάζεται μόνο να προσθέσουμε όλες τις πιέσεις ατμών των διαφόρων ενώσεων για να πάρουμε την απάντησή μας.
- Για παράδειγμα, ας πούμε ότι έχουμε ένα διάλυμα που αποτελείται από δύο χημικά: βενζόλιο και τολουόλιο. Ο συνολικός όγκος του διαλύματος είναι 12 χιλιοστόλιτρα (mL). 60 mL βενζολίου και 60 mL τολουόλιο. Η θερμοκρασία του διαλύματος είναι 25 ° C και οι πιέσεις ατμού καθενός από αυτά τα χημικά στους 25 ° C είναι 95,1 mm Hg για βενζόλιο και 28,4 mm Hg για τολουόλιο. Με αυτές τις τιμές, βρείτε την πίεση ατμών του διαλύματος. Μπορούμε να το κάνουμε ως εξής, χρησιμοποιώντας τυπικές τιμές πυκνότητας, γραμμομοριακής μάζας και πίεσης ατμού για τις δύο χημικές μας ουσίες:
- Μάζα (βενζόλιο): 60 mL = 0.060 L & χρόνοι 876.50 kg/1.000 L = 0.053 kg = 53 γρ
- Μάζα (τολουόλιο): 0.060 L & χρόνοι 866, 90 kg/1.000 L = 0.052 kg = 52 γρ
- Mol (βενζόλιο): 53 g × 1 mol/78, 11 g = 0,679 mol
- Moles (τολουόλιο): 52 g × 1 mol/92, 14 g = 0.564 mol
- Συνολικοί κρεατοελιές: 0,679 + 0,564 = 1,243
- Μόριο κλάσμα (βενζόλιο): 0,679/1, 243 = 0,546
- Μόριο κλάσμα (τολουόλιο): 0.564/1, 243 = 0.454
- Λύση: Ρλύση = ΡβενζόλιοΧβενζόλιο + ΡτολουΐνηΧτολουΐνη
- Πλύση = (95,1 mm Hg) (0, 546) + (28,4 mm Hg) (0, 454)
- Πλύση = 51,92 mm Hg + 12,89 mm Hg = 64, 81 mm Hg
Συμβουλές
- Για να χρησιμοποιήσετε την εξίσωση Clausius Clapeyron παραπάνω, η θερμοκρασία πρέπει να μετρηθεί σε Kelvin (γραμμένο ως K). Εάν έχετε τη θερμοκρασία σε Κελσίου, τότε πρέπει να τη μετατρέψετε χρησιμοποιώντας τον ακόλουθο τύπο: Τκ = 273 + Τντο
- Οι παραπάνω μέθοδοι μπορούν να χρησιμοποιηθούν επειδή η ενέργεια είναι ακριβώς ανάλογη με την ποσότητα θερμότητας που εφαρμόζεται. Η θερμοκρασία του υγρού είναι ο μόνος περιβαλλοντικός παράγοντας που επηρεάζει την πίεση ατμών.






